新冠病毒抗原检测试剂将被临时纳入医保范围
新冠病毒抗原检测试剂将被临时纳入医保范围,自国家层面将新冠抗原检测纳入应用,新冠抗原检测试剂专项集中采购开标后,试剂价格已降了许多,新冠病毒抗原检测试剂将被临时纳入医保范围。
据国家医疗保障局消息 国家医疗保障局21日就切实做好当前疫情防控医疗保障工作发布通知,要求按程序将新冠病毒抗原检测试剂及相应检测项目临时性纳入本省份基本医保医疗服务项目目录。
《通知》指出,各省级医疗保障部门应根据《新型冠状病毒肺炎诊疗方案(试行第九版)》和《新型冠状病毒肺炎防控方案(试行第九版)》,综合考虑疫情防控需要、本地区医保基金支付能力,按照科学精准、积极稳妥、风险可控的原则,及时调整优化医保相关政策。

《通知》要求,按程序将新冠病毒抗原检测试剂及相应检测项目临时性纳入本省份基本医保医疗服务项目目录。参保人在定点基层医疗机构发生的相关费用按统筹地区现行规定支付,在定点零售药店购买检测试剂的费用,可使用个人账户支付。各省级医疗保障部门参照相关文件,持续规范和优化公立医疗机构提供新冠抗原检测服务的价格政策。
各地医药集中采购机构要做好新冠病毒抗原检测试剂挂网工作,积极推动挂网采购并依托全国统一的医保信息平台进行信息共享。同时加强测算和监测,协同推进价格、采购、支付和信息系统改造各项工作。
《通知》还指出,要及时调整纳入医保支付范围的新冠治疗用药。对诊疗方案(试行第九版)新增药品,各省级医疗保障部门参照相关要求,将其临时性纳入本省份医保基金支付范围;对于诊疗方案(试行第九版)调出且不在基本医保目录内的药品,各省级医疗保障部门应在诊疗方案(试行第九版)发布之日起停止医保支付。
此外,《通知》要求各省级医疗保障部门做好新增药品挂网工作,对于尚未挂网的药品,允许医疗机构先在线下采购应急使用。诊疗方案(试行第九版)新增的奈玛特韦片/利托那韦片,由医疗机构按照企业与有关部门沟通一致的价格采购,医保部门按规定做好支付。
国家医保局发布通知,要求各地将新冠病毒抗原检测试剂及相应检测项目临时性纳入本省份基本医保医疗服务项目目录;对于新型冠状病毒肺炎诊疗方案的新增药品,将其临时性纳入本省份医保基金支付范围。“纳入医保”的指向就是为患者减负。
将新冠抗原检测临时性纳入医保,无疑是有的放矢:就在3月11日,国务院联防联控机制综合组印发了《新冠病毒抗原检测应用方案(试行)》,决定在核酸检测基础上增加抗原检测作为补充。按照国家卫健委的特别说明,接下来,将推进“抗原筛查、核酸诊断”的监测模式。
得看到,自国家层面将新冠抗原检测纳入应用,新冠抗原检测试剂专项集中采购开标后,试剂价格已由市场平均价格30多元/人份降至最低价7.9元/人份。如今,在很多地方,新冠抗原检测成本已大幅降低:如深圳市自3月16日起执行9.8元/人份的集采中选试剂盒价格;黑龙江、云南、陕西、山西等地均已明确,单人单次抗原检测项目和抗原检测试剂收费总和不得超过15元/次。
尽管如此,考虑到自测抗原挺考验个体配合度,若是费用自担,难免会影响部分人的自检测积极性。在此背景下,将新冠抗原检测临时性纳入医保,自然释放出了普惠信号:此举能带动特定人群“应测尽测”,方便快速筛查和分流管理,以更快地缩短传播链。
如今,出现疫情后,很多地方都会开展大规模核酸检测。大规模意味着点多、线长、面广,这会增加整个社会的筛查成本,包括耗费大量医务人员精力。而新冠抗原检测纳入医保,能以普惠促善用,人们居间自测抗原的配合度会更高,在其“补充”下,核酸检测的.针对性可以更强。
从防疫角度讲,抗原检测的“立等可见”,能带来“早发现”的效果。一旦检测呈阳性,可以早隔离、早救治,让自己尽快获得医疗资源,也避免身边人被感染。
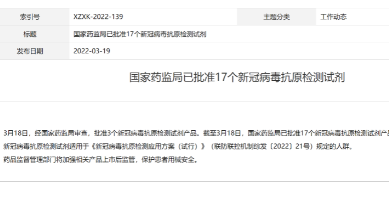
值得注意的是,截至3月18日,国家药监局已批准了17个新冠抗原检测试剂产品,可以预见的是,随着新冠抗原检测入各地医保,地方层面的药品集采带量采购,势必会推动新冠抗原检测试试剂价格继续下探。
要知道,目前开销的新冠抗原试剂盒,从制造端的成本4-5元,到销售端的14.5元,依旧存在不小的利润空间。对试剂厂商来说,医保以量换价会倒逼他们采取薄利多销,带动良性竞争。
要“努力用最小的代价实现最大的防控效果”,疫情防控成本就得算大账。而新冠抗原检测纳入医保,算的就是新冠病毒筛查整体“降本增效”的大账。
据国家药监局官网消息,3月18日,经国家药监局审查,批准3个新冠病毒抗原检测试剂产品。截至目前,国家药监局已批准17个新冠病毒抗原检测试剂产品。
千亿市场或可期
据悉,3月11日,国家卫健委发布《关于印发新冠病毒抗原检测应用方案(试行)的通知》,应对新型冠状病毒肺炎疫情联防联控机制综合组决定在核酸检测基础上,增加抗原检测作为补充,并组织制定了《新冠病毒抗原检测应用方案(试行)》(下称“方案”)。
官方显示,截至目前,国家药监局已陆续批准了华科泰生物、诺唯赞、金沃夫生物、华大因源、万孚生物、万泰生物、热景生物、博奥赛斯、明德生物、乐普医疗、明道捷测、东方生物、艾康生物等在内的17家新冠抗原/抗体检测试剂盒产品的注册申请。
政策落地,多家机构预测国内抗原检测试剂需求量。浙商证券认为,在仅考虑《方案》中的三类场景下,,随着后续政策的落地以下市场空间有望后续打开,中性假设下每年检测的市场空间约为620 亿元,试剂的市场空间约为 380 亿元,合计潜力市场空间近千亿。
但对于是否能替代核酸检测,上海市卫生健康委主任邬惊雷也在今日的新闻发布会表示,新冠抗原检测主要用于人群快速筛查和分流管理,以缩短传播链,优点是快速、简单、易行,缺点是敏感性不如核酸检测,可能出现漏诊。目前抗原检测是作为新冠肺炎检测的补充手段,核酸检测仍然是新冠肺炎感染的确诊依据,抗原检测阴性不可替代核酸阴性证明。
多家试剂厂商披露产能和申报进度
目前,多家试剂厂商也陆续披露产能,确保供应。
东方生物今日发布消息称,公司新冠抗原检测试剂日产能1800万人份左右,在确保技术指标、产品质量的前提下,进一步提升产能配套能力,尽力确保国内外检测需求,优先满足政府集采以及居民抗原自我检测等领域的需求。
3月12日,北京金沃夫生物工作人员在接受媒体采访时透露,目前有1000万人份的订单,公司将加人手把抗原检测试剂盒产能提高到170万人份/天,2000名工人,两班倒,全力开工生产,尽最大产能满足国内市场需求。
万孚生物市场部相关人士也透露,已建立33000平方米的快速诊断产品产业化基地,配备5000平方米的洁净生产车间和快速诊断试剂生产线,日产量达150万人份。
除此之外,据《科创板日报》不完全统计,已有硕世生物、迈克生物、鱼跃医疗、新产业、达安基因等在内的8家IVD上市公司披露新冠抗原产品申报进度。
其中,圣湘生物3月13日在互动平台表示,目前可居家自测使用的新冠抗原检测产品已在申请欧盟CE认证及美国FDA认证,将进一步为国际疫情的防控提供多样化的鉴定和检测方案,提升公司产品的综合竞争力。
迪安诊断3月18日在互动平台表示,子公司迪安生物的新冠抗原检测试剂注册正在积极申请,最大日产能已提升到100万人份/天。
九强生物3月14日在互动平台表示,公司抗原检测试剂主要销售地区为欧洲的意大利等国家,国内整个诊断市场中,国外厂商有明显的优势。公司正在积极推进国内新冠抗原检测注册证的申请,进一步助力国内新冠疫情防控工作。
【新冠病毒抗原检测试剂将被临时纳入医保范围】相关文章:
我国已批准14个新冠病毒抗原检测试剂产品03-18
新冠病毒抗原检测试剂盒现货不足需预约03-17
居民现可购买新冠抗原检测试剂自测03-14
卫健委公布新冠抗原检测试剂自测流程03-14
新冠抗原自测试剂的售价03-14
新冠抗原自测试剂结果准吗03-14
新冠抗原自测试剂能代替核酸吗03-14